Page 90 -
P. 90
більш дисперсною мікроструктурою порошку потрійного композиту (табл.
3.10).
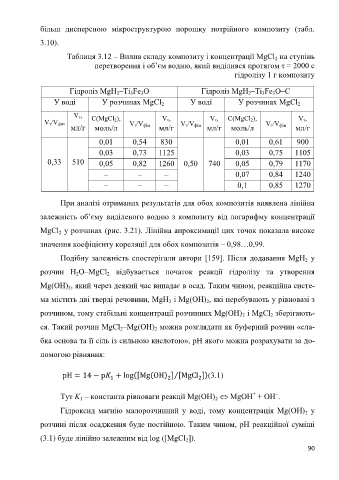
Таблиця 3.12 – Вплив складу композиту і концентрації MgCl на ступінь
2
перетворення і об’єм водню, який виділився протягом τ = 2000 с
гідролізу 1 г композиту
Гідроліз MgH –Ti Fe O Гідроліз MgH –Ti Fe O–C
3
3
2
3
2
3
У воді У розчинах MgCl У воді У розчинах MgCl
2
2
V τ, C(MgCl 2), V τ, V τ, C(MgCl 2), V τ,
V τ/V фін V τ/V фін V τ/V фін V τ/V фін
мл/г моль/л мл/г мл/г моль/л мл/г
0,01 0,54 830 0,01 0,61 900
0,03 0,73 1125 0,03 0,75 1105
0,33 510 0,05 0,82 1260 0,50 740 0,05 0,79 1170
– – – 0,07 0,84 1240
– – – 0,1 0,85 1270
При аналізі отриманих результатів для обох композитів виявлена лінійна
залежність об’єму виділеного водню з композиту від логарифму концентрації
MgCl у розчинах (рис. 3.21). Лінійна апроксимації цих точок показала високе
2
значення коефіцієнту кореляції для обох композитів – 0,98…0,99.
Подібну залежність спостерігали автори [159]. Після додавання MgH у
2
розчин H O–MgCl відбувається початок реакції гідролізу та утворення
2
2
Mg(OH) , який через деякий час випадає в осад. Таким чином, реакційна систе-
2
ма містить дві тверді речовини, MgH і Mg(OH) , які перебувають у рівновазі з
2
2
розчином, тому стабільні концентрації розчинних Mg(OH) і MgCl зберігають-
2
2
ся. Такий розчин MgCl –Mg(OH) можна розглядати як буферний розчин «сла-
2
2
бка основа та її сіль із сильною кислотою», pН якого можна розрахувати за до-
помогою рівняння:
([ ( ) ] [ ]⁄ )(3.1)
+
–
Тут K – константа рівноваги реакції Mg(OH) MgOH + OH .
1
2
Гідроксид магнію малорозчинний у воді, тому концентрація Mg(OH) у
2
розчині після осадження буде постійною. Таким чином, рН реакційної суміші
(3.1) буде лінійно залежним від log ([MgCl ]).
2
90