Page 131 -
P. 131
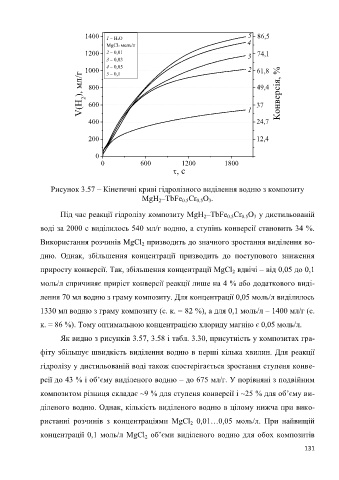
1400 1 H2O 5 86,5
MgCl2 моль/л 4
1200 2 0,01 74,1
3 0,03 3
1000 4 0,05 2 61,8
), мл/г 800 49,4 Конверсія, %
5 0,1
V(H 2 600 1 37
400 24,7
200 12,4
0
0 600 1200 1800
, с
Рисунок 3.57 – Кінетичні криві гідролізного виділення водню з композиту
MgH –TbFe Cr O .
0.5
0.5
2
3
Під час реакції гідролізу композиту MgH –TbFe Cr O у дистильованій
0.5
3
2
0.5
воді за 2000 с виділилось 540 мл/г водню, а ступінь конверсії становить 34 %.
Використання розчинів MgCl призводить до значного зростання виділення во-
2
дню. Однак, збільшення концентрації призводить до поступового зниження
приросту конверсії. Так, збільшення концентрації MgCl вдвічі – від 0,05 до 0,1
2
моль/л спричиняє приріст конверсії реакції лише на 4 % або додаткового виді-
лення 70 мл водню з граму композиту. Для концентрації 0,05 моль/л виділилось
1330 мл водню з граму композиту (с. к. = 82 %), а для 0,1 моль/л – 1400 мл/г (с.
к. = 86 %). Тому оптимальною концентрацією хлориду магнію є 0,05 моль/л.
Як видно з рисунків 3.57, 3.58 і табл. 3.30, присутність у композитах гра-
фіту збільшує швидкість виділення водню в перші кілька хвилин. Для реакції
гідролізу у дистильованій воді також спостерігається зростання ступеня конве-
рсії до 43 % і об’єму виділеного водню – до 675 мл/г. У порівняні з подвійним
композитом різниця складає ~9 % для ступеня конверсії і ~25 % для об’єму ви-
діленого водню. Однак, кількість виділеного водню в цілому нижча при вико-
ристанні розчинів з концентраціями MgCl 0,01…0,05 моль/л. При найвищій
2
концентрації 0,1 моль/л MgCl об’єми виділеного водню для обох композитів
2
131