Page 26 - дисертація головей3-converted
P. 26
27
2+
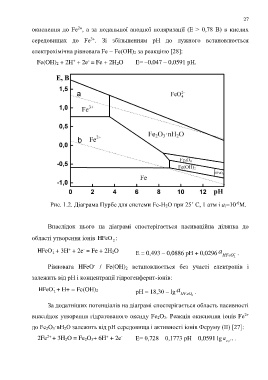
окиснення до Fe , а за подальшої анодної поляризації (Е > 0,78 В) в кислих
3+
середовищах до Fe . Зі збільшенням рН до лужного встановлюється
електрохімічна рівновага Fe − Fe(OH) 2 за реакцією [28]:
-
+
Fe(OH) 2 + 2H + 2e = Fe + 2H 2O Е= –0,047 – 0,0591 рН.
-6
Рис. 1.2. Діаграма Пурбе для системи Fe-H 2O при 25˚ С, 1 атм і a i=10 М.
Внаслідок цього на діаграмі спостерігається пасиваційна ділянка до
-
області утворення іонів HFeO :
2
+
-
-
HFeO + 3H + 2e = Fe + 2H 2O a
2 E = 0,493 – 0,0886 pH + 0,0296 HFeO − .
2
-
Рівновага HFeO / Fe(OH) 2 встановлюється без участі електронів і
залежить від рН і концентрації гідрогенферит-іонів:
-
HFeO + H+ = Fe(OH) 2 рН = 18,30 – lg a HFeO 2 − .
2
За додатніших потенціалів на діаграмі спостерігається область пасивності
внаслідок утворення гідратованого оксиду Fe 2O 3. Реакція окиснення іонів Fe 2+
до Fe 2O 3·nH 2O залежить від рН середовища і активності іонів Феруму (ІІ) [27]:
2+
+
-
2Fe + 3H 2O = Fe 2O 3+ 6H + 2e Е= 0,728 – 0,1773 рН – 0,0591 lg a 2 .
Fe +