Page 23 - дисертація головей3-converted
P. 23
24
Тому необхідно розглянути умови перетікання окисно-відновних реакцій
в системах H 2O-S, H 2O-Fe і H 2O-Fe-S та можливість утворення різних за
складом продуктів корозії. Для цього використовують діаграми Пурбе [23, 24].
1.1 Окисно-відновні реакції Сульфуру у водних розчинах
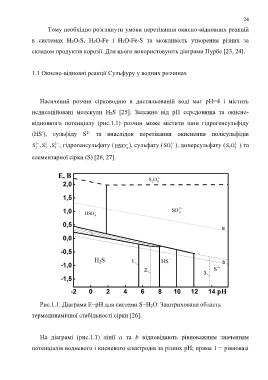
Насичений розчин сірководню в дистильованій воді має рН=4 і містить
недисоційовані молекули H 2S [25]. Залежно від рН середовища та окисно-
відновного потенціалу (рис.1.1) розчин може містити іони гідрогенсульфіду
-
2-
(HS ), сульфіду S та внаслідок перетікання окиснення полісульфідів
−
−
−
S ,S ,S , гідрогенсульфату ( HSO ), сульфату (SO ), диперсульфату ( O ) та
−
−
2
−
2
2
2
2
S
8
2
3
4
2
4
4
елементарної сірки (S) [26, 27].
Рис.1.1. Діаграма Е−рН для системи S−Н 2О. Заштрихована область
термодинамічної стабільності сірки [26].
На діаграмі (рис.1.1) лінії a та b відповідають рівноважним значенням
потенціалів водневого і кисневого електродів за різних рН; пряма 1 − рівновазі