Page 22 - Microsoft Word - aref_Korniy_final.doc
P. 22
20
Загалом взаємодія іонів водню з кисневими центрами каркаса цеоліту
призводить до утворення гідроксильних груп та зниження заряду матриці цеоліту,
що супроводжується послабленням сорбційної здатності цеолітів до деяких катіонів
металів. Квантово-хімічні розрахунки енергії взаємодії іонів водню з кластером
цеоліту Ze(SiO 2) 30 свідчать про стабілізацію структури із підвищенням симетрії її
зв’язків аж до повного заповнення кисневих центрів поверхні кластера іонами
водню на віддалі близько 0,88 Å. При цьому на іонах водню локалізується
незначний усереднений додатний заряд 0,36е, значення якого практично не
змінюється зі збільшенням сорбованих іонів.
Простежується збільшення енергії зв’язку вказаних іонів із кластером цеоліту
Ze(SiO 2) 30 з підвищенням кількості сорбованих іонів на ньому. Зазначимо, що іони
цинку досить міцно зв’язані, що призводить до значного перенесення додатного
заряду на кластер (на іоні цинку залишається близько 0,33…0,45е заряду),
зменшення віддалі Zn–O до 1,7…1,9 Å та деформування вихідної структури
кластера цеоліту. Це може свідчити про блокування іонами цинку кисневих центрів
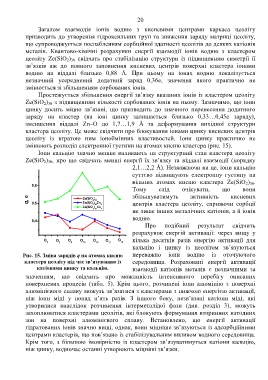
цеоліту із втратою ним іонобмінних властивостей. Іони цинку практично не
змінюють розподіл електронної густини на атомах кисню кластера (рис. 15).
Іони кальцію значно менше впливають на структурний стан кластера цеоліту
Ze(SiO 2) 30, про що свідчать менші енергії їх зв’язку та віддалі взаємодії (порядку
2,1…2,2 Å). Незважаючи на це, іони кальцію
суттєво підвищують електронну густину на
вільних атомах кисню кластера Ze(SiO 2) 30.
0,6
Тому слід очікувати, що вони
q, e 0,5 Ze(SiO ) 2 30 збільшуватимуть активність кисневих
Ze(SiO ) Zn
2 30
Ze(SiO ) Ca 4 центрів кластера цеоліту, сприяючи сорбції
2 30 4
не лише інших металічних катіонів, а й іонів
водню.
0,4
Про подібний результат свідчить
розрахунок енергій активації: через вищу у
O O O O O O O кілька десятків разів енергію активації для
1 3 6 11 15 17 19
кальцію і цинку із цеолітом зв’язуються
Рис. 15. Зміна зарядів q на атомах кисню переважно іони водню із оточуючого
кластера цеоліту під час зв’язуванню із середовища. Розраховані енергії активації
катіонами цинку та кальцію. взаємодії катіонів металів є незначними за
значенням, що свідчить про можливість інтенсивного перебігу описаних
поверхневих процесів (табл. 5). Крім цього, розчинені іони алюмінію з поверхні
алюмінієвого сплаву можуть зв’язатися з кластерами з нижчою енергією активації,
ніж іони міді у понад п’ять разів. З іншого боку, незв’язані катіони міді, які
утворилися внаслідок розчинення інтерметалідої фази (див. розділ 3), можуть
захоплюватися кластерами цеолітів, які блокують формування вторинних катодних
зон на поверхні алюмінієвого сплаву. Встановлено, що енергії активації
гідратованих іонів значно вищі, однак, вони міцніше зв’язуються із адсорбційними
центрами кластерів, що пов’язано із стабілізувальним впливом водного середовища.
Крім того, з більшою імовірністю із кластером зв’язуватимуться катіони кальцію,
ніж цинку, водночас останні утворюють міцніші зв’язки.