Page 15 - Microsoft Word - aref_Korniy_final.doc
P. 15
13
енергетичний бар’єр виходу алюмінію з інтерметаліду є нижчий проти чистого
кластера алюмінію майже вдвічі.
Таким чином, перенесення електронів між Сu та Al є важливим чинником у
зміні енергії виходу (іонізації) внаслідок різної електронегативності міді та
алюмінію, збільшення міжатомних віддалей алюмінію в інтерметаліді порівняно із
чистим алюмінієм, а також меншого координаційного числа.
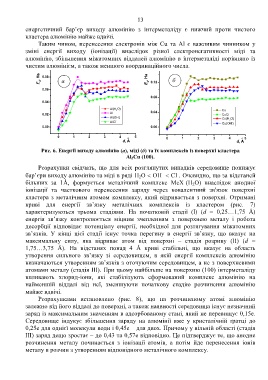
E d , Ha 0.08 а E d , Ha 0.12 б
0.06
0.08
0.04
Al(H O)
2 0.04 Cu
0.02 Al CuCl -
Al(OH ) - Cu(H O)
- 2
AlCl -
Cu(OH )
0.00 0.00
0 1 2 3 4 o 5 0 1 2 3 4 o 5
d, A d, A
Рис. 6. Енергії виходу алюмінію (а), міді (б) та їх комплексів із поверхні кластера
Al 2Cu (100).
Розрахунки свідчать, що для всіх розглянутих випадків середовище понижує
–
–
бар’єри виходу алюмінію та міді в ряді H 2O OH Cl . Очевидно, що за відстаней
–
більших за 1Å, формується металічний комплекс MeX (H 2O) внаслідок анодної
іонізації та часткового перенесення заряду через ковалентний зв'язок поверхні
кластера з металічним атомом комплексу, який відривається з поверхні. Отримані
криві для енергії зв’язку металічних комплексів із кластером (рис. 7)
характеризуються трьома стадіями. На початковій стадії (І) (d = 0,25…1,75 Å)
енергія зв’язку контролюється міцним зчепленням з поверхнею металу і робота
десорбції відповідає потенціалу енергії, необхідної для розтягування міжатомних
зв’язків. У кінці цієї стадії існує точка перегину в енергії зв’язку, що вказує на
максимальну силу, яка відриває атом від поверхні – стадія розриву (ІІ) (d =
1,75…3,75 Å). На відстанях понад 4 Å криві стабільні, що вказує на область
утворення сильного зв’язку зі середовищем, в якій енергії комплексів алюмінію
визначаються утворенням зв’язків з оточуючим середовищем, а не з поверхневими
атомами металу (стадія ІІІ). При цьому найбільше на поверхню (100) інтерметаліду
впливають хлорид-іони, які стабілізують сформований комплекс алюмінію на
найменшій віддалі від неї, зменшуючи початкову стадію розчинення алюмінію
майже вдвічі.
Розрахунками встановлено (рис. 8), що на розчиненому атомі алюмінію
залежно від його віддалі до поверхні, а також наявності середовища існує незначний
заряд із максимальним значенням в адсорбованому стані, який не перевищує 0,15е.
Середовище індукує збільшення заряду на алюмінії вже у кристалічній ґратці до
0,25е для однієї молекули води і 0,45е – для двох. Причому у вільній області (стадія
ІІІ) заряд дещо зростає – до 0,43 та 0,57е відповідно. Це підтверджує те, що анодне
розчинення металу починається з іонізації атомів, а потім йде перенесення іонів
металу в розчин з утворенням відповідного металічного комплексу.