Page 177 - Korniy_dyser
P. 177
177
Хоча при цьому залишається не виясненим питання щодо поверхневого
збагачення поверхні інтерметаліду атомами міді (Cu-enrichment). Ці питання
стосуються розподілу міді на поверхні та його можливість розчинення і
осадження на інших структурних фазах дюралюмінію. Очевидно, такі
дослідження поряд із квантово-хімічним описом потребують
експериментального вивчення методами мікроелектрохімії із використанням
сучасних методів поверхневого аналізу.
Отже, стосовно корозійного розчинення інтерметалідна фаза є
складною електрохімічною системою з катодними та анодними зонами,
якими можуть служити ділянки із різною кристалографічною орієнтацією
поверхні або створені внаслідок часткового електронного переносу локальні
адсорбційні центри алюміній–мідь.
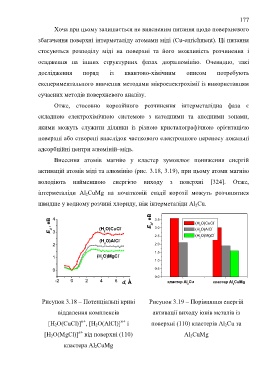
Внесення атомів магнію у кластер зумовлює пониження енергій
активацій атомів міді та алюмінію (рис. 3.18, 3.19), при цьому атоми магнію
володіють найменшою енергією виходу з поверхні [324]. Отже,
інтерметаліди Al 2CuMg на початковій стадії корозії можуть розчинятися
швидше у водному розчині хлориду, ніж інтерметаліди Al 2Cu.
4 E D , еВ 3.5 -
3 E d , еВ (H O)CuCl - 3.0 (H O)CuCl -
2
(H O)AlCl
2
2
2.5 (H O)MgCl -
- 2
(H O)AlCl
2 2 2.0
1.5
-
1 (H O)MgCl
2
1.0
0 0.5
0.0
o
-2 0 2 4 6 d, A кластер Al Cu кластер Al CuMg
2
2
Рисунок 3.18 – Потенціальні криві Рисунок 3.19 – Порівняння енергій
віддалення комплексів активації виходу іонів металів із
n+
n+
[H 2O(CuCl)] , [H 2O(AlCl)] і поверхні (110) кластерів Al 2Cu та
n+
[H 2O(MgCl)] від поверхні (110) Al 2CuMg
кластера Al 2CuMg