Page 163 - Korniy_dyser
P. 163
163
будовою, а з іншого боку, більш високою енергією зв’язку іона хлору на ній
порівняно із поверхнею (100).
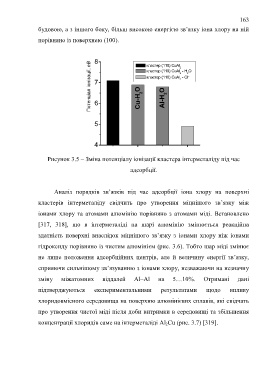
8 кластер (110) CuAl 2 2 2
Потенціал іонізації, еВ 7 Cu-H 2 O кластер (110) CuAl - Cl _
кластер (110) CuAl - H O
2
Al-H 2 O
6
5
4
Рисунок 3.5 – Зміна потенціалу іонізації кластера інтерметаліду під час
адсорбції.
Аналіз порядків зв’язків під час адсорбції іона хлору на поверхні
кластерів інтерметаліду свідчить про утворення міцнішого зв’язку між
іонами хлору та атомами алюмінію порівняно з атомами міді. Встановлено
[317, 318], що в інтерметаліді на шарі алюмінію змінюється реакційна
здатність поверхні внаслідок міцнішого зв’язку з іонами хлору ніж іонами
гідроксиду порівняно із чистим алюмінієм (рис. 3.6). Тобто шар міді змінює
не лише положення адсорбційних центрів, але й величину енергії зв’язку,
сприяючи сильнішому зв’язуванню з іонами хлору, незважаючи на незначну
зміну міжатомних віддалей Al–Al на 5…10%. Отримані дані
підтверджуються експериментальними результатами щодо впливу
хлоридовмісного середовища на поверхню алюмінієвих сплавів, які свідчать
про утворення чистої міді після доби витримки в середовищі та збільшення
концентрації хлоридів саме на інтерметаліді Al 2Cu (рис. 3.7) [319].